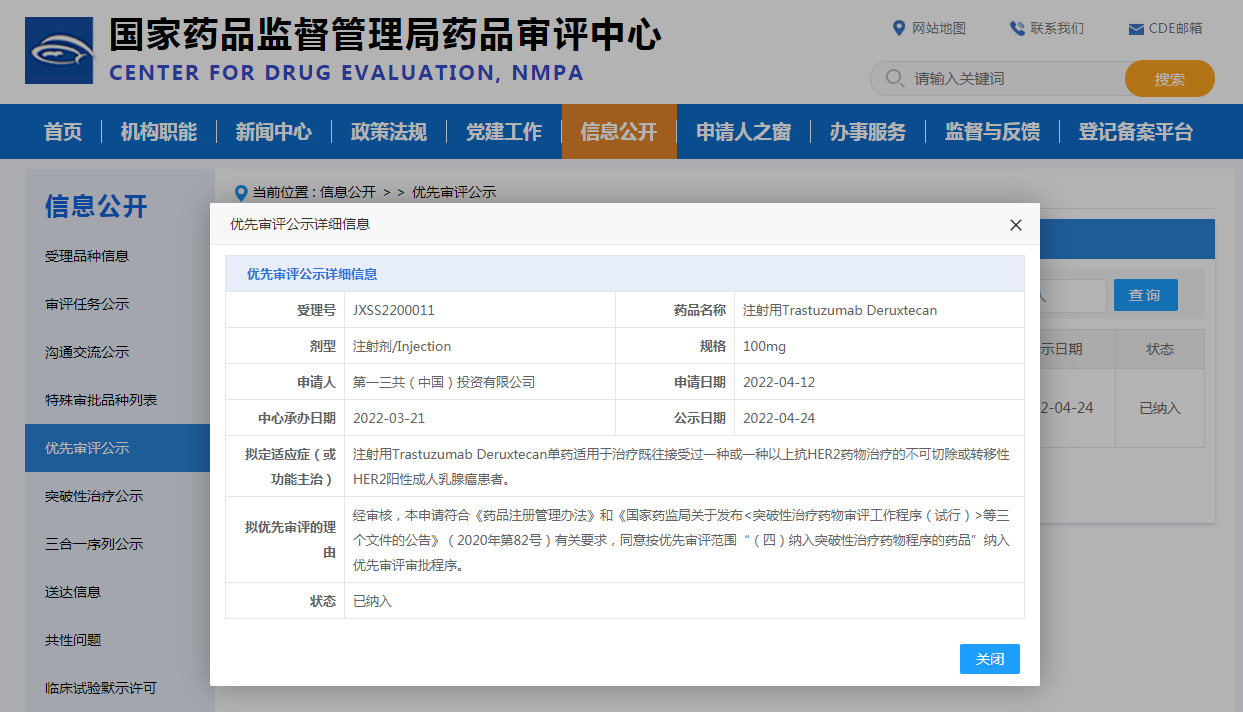
5月6日,中国国家药监局药品审评中心(CDE)官网公示,注射用Trastuzumab Deruxtecan的上市申请被纳入优先审评,用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
截图来源:CDE官网
Trastuzumab Deruxtecan是一种由第一三共和阿斯利康联合开发的一款靶向HER2的抗体偶联药物(ADC),由人源化抗HER2 lgG1抗体、可裂解的四肽连接子和拓扑异构酶I抑制剂(喜树碱衍生物DXd)组成,已在国外获批上市。在中国,Trastuzumab Deruxtecan的上市申请在2022年3月获得中国国家药监局药品审评中心(CDE)受理,并在昨日被纳入拟优先审评。此次上市申请是基于大型临床III期研究DESTINY-Breast03在2021年欧洲肿瘤内科学会(ESMO)大会上公布的关键性数据。这个数据也在2022年3月发表在《新英格兰医学杂志》(NEJM)上,也是Trastuzumab Deruxtecan的相关研究结果第五次刊登在《新英格兰医学杂志》。
关于乳腺癌
乳腺癌是全球女性癌症相关死亡的主要因之一。在2020年,全球确诊的乳腺癌患者超过200万,并导致近68万人死亡。其中,HER2阳性乳腺癌大约占全部乳腺癌的五分之一。HER2是一种酪氨酸激酶受体生长促进蛋白,表达于多种肿瘤的表面,包括乳腺癌、胃癌、肺癌和结直肠癌。HER2蛋白过度表达可能是HER2基因扩增的结果,通常与侵袭性疾病和预后不良有关。
尽管近年来已取得治疗进展并且有多款新药获批,但在HER2阳性转移性乳腺癌患者中仍存在着未被满足的临床需求。这种疾病当前依然治愈困难,患者在接受目前可用的疗法后往往会出现疾病进展,需要更多的治疗方案来进一步延缓疾病进展,延长患者生存时间。
第一三共(中国)开发总部总经理绪方恒晖博士表示:“在中国,乳腺癌发病率位列女性恶性肿瘤之首,Trastuzumab Deruxtecan填补HER2阳性晚期未被满足的治疗需求,将为中国HER2阳性乳腺癌患者开创新的治疗局面”。
