药品关联审评审批政策进一步明确
为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),原食品药品监管总局发布了《关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年第146号),就进一步明确原料药、药用料、直接接触药品的包装材料和容器与药品制剂关联审评审批和监管有关事宜发出相关公告。
吸入用盐酸氨溴索溶液上市申请获批准进口
7月11日,韩美提交的吸入用盐酸氨溴索溶液的上市申请(JXHS1700033)获得国家食品药品监督管理局批准进口,成为国内第一个吸入剂型的氨溴索产品。氨溴索因为其祛痰作用而深受临床医生欢迎,导致注射剂被广泛用于呼吸系统疾病患者的雾化治疗。氨溴索在国内医院市场约有31亿元的市场规模,其中92%都是来自于注射剂型。此次韩美入用盐酸氨溴索溶液以【儿童用药】的理由进入优先审评通道,满足了广大儿科患者临床需求的同时,也将对氨溴索的市场格局造成颠覆性的影响。
批准情况
本周国内批准生产1项,批准进口4项。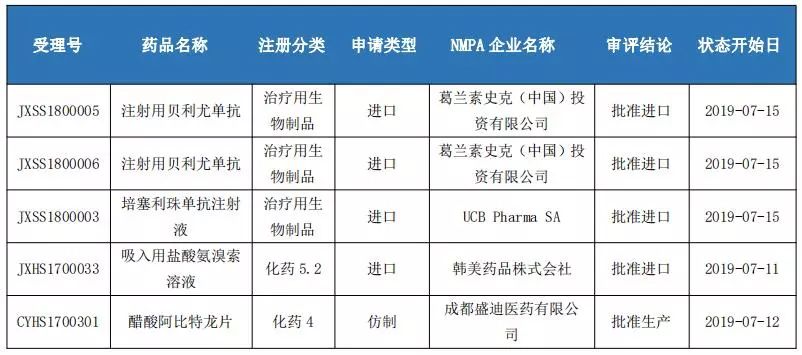

国内申报情况
本周CDE 承办的受理号一共135项。其中,1类新药申请临床10项,2 类改型新药申请上市4项,3类仿制药申请2项,4类仿制药申请12 项,仿制药一致性评价12项,境外上市化学药品申报上市12项。生物制品申请上市4项,申请临床2项,补充申请7项。
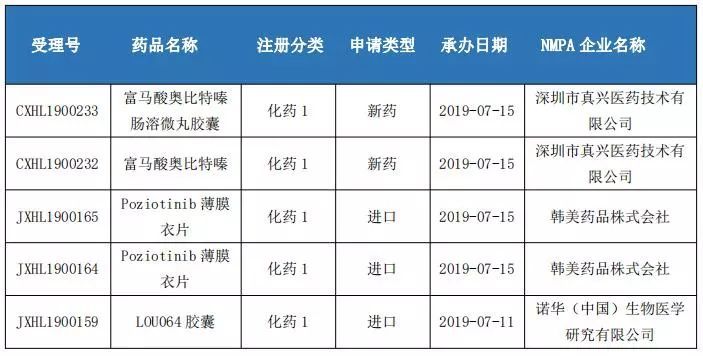
国内1类新药申报情况
国内1类新药申报情况
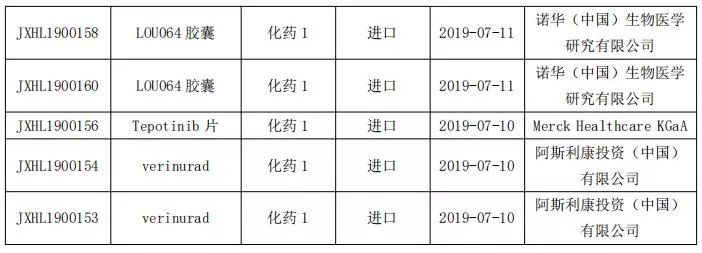
国内改良型新药申报情况
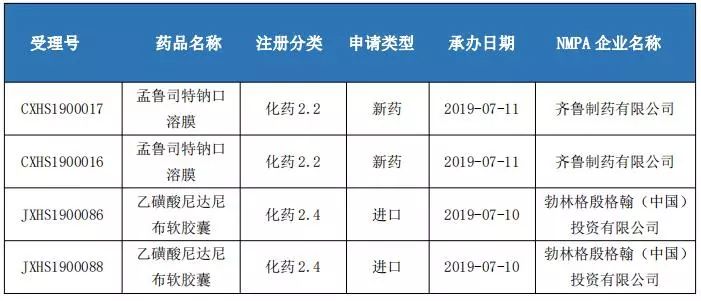
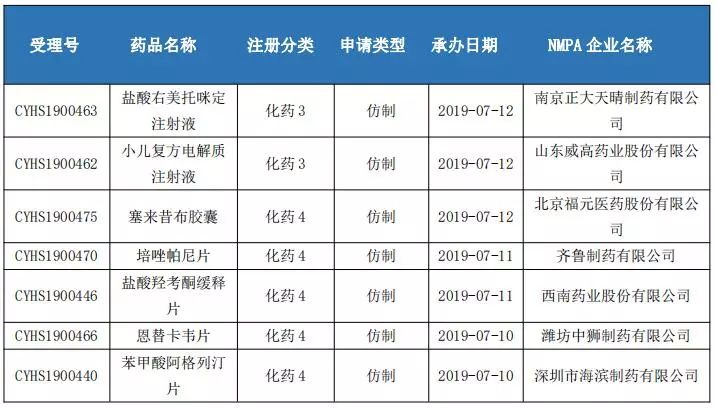
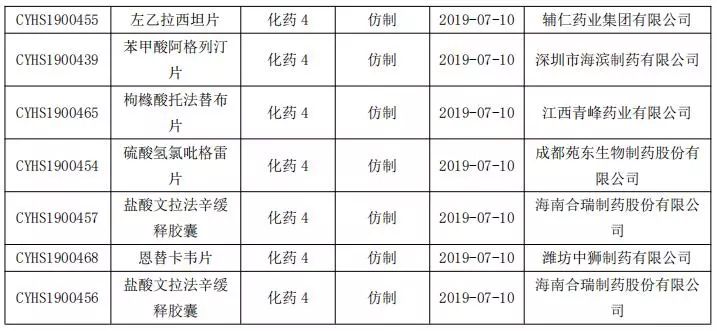
3、4类仿制药申报情况


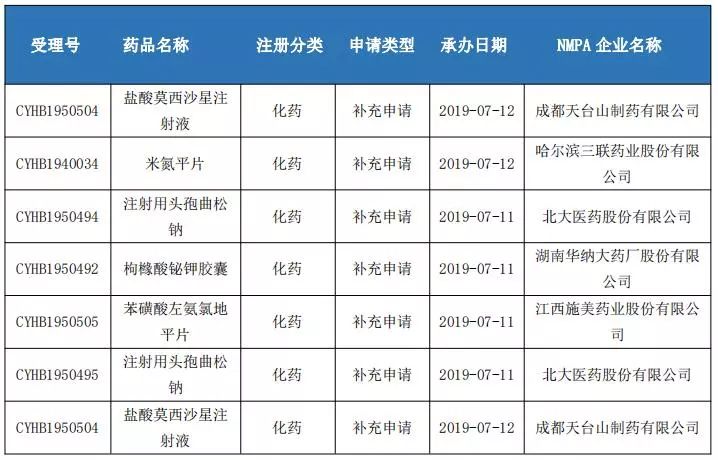
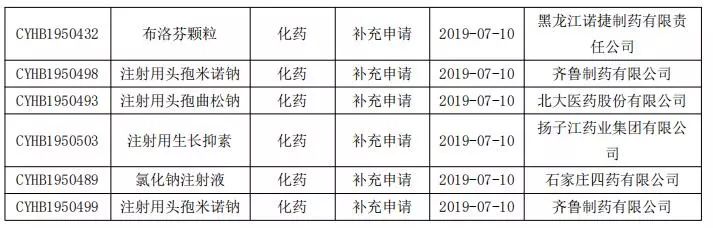
仿制药一致性评价申报情况
境外上市药品申请上市情况
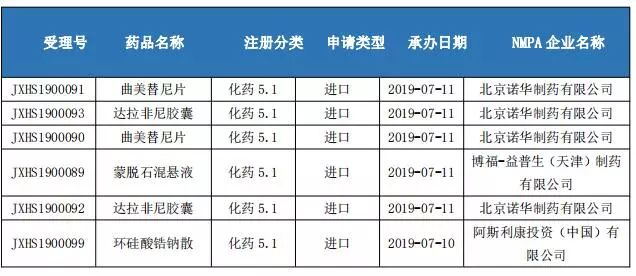

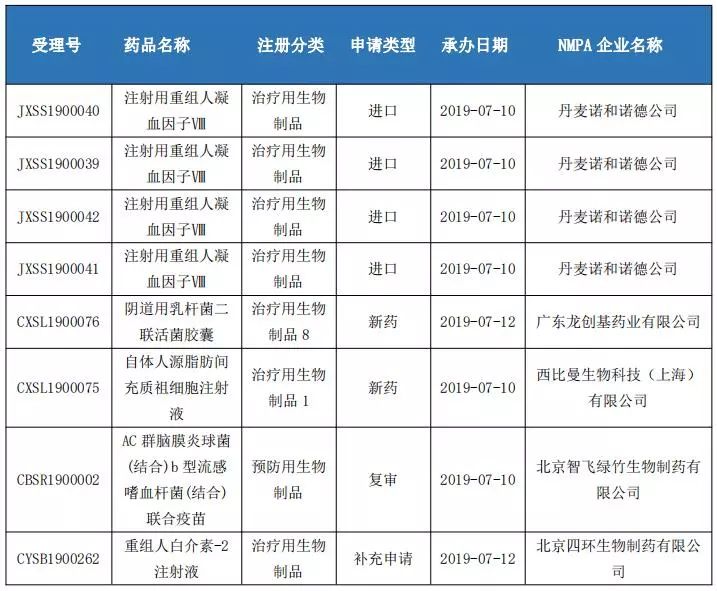
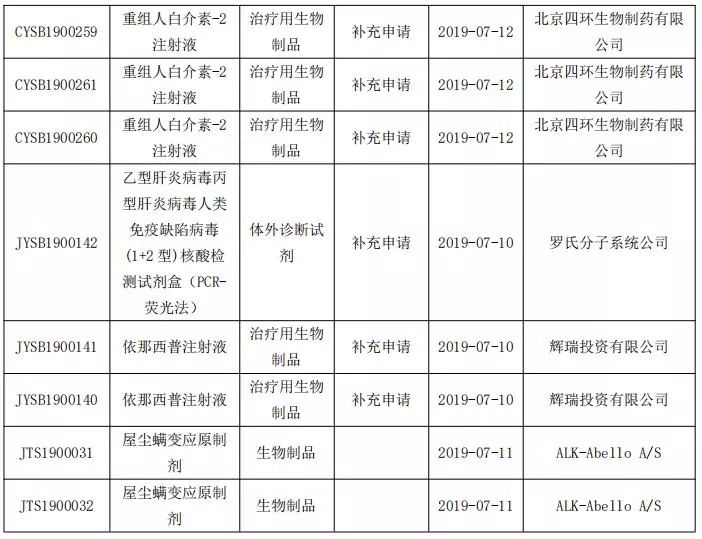
生物制品申报情况
来源:Drugfocus药研视界
注:本文为载,仅做分享之用,对文章观点保持中立,侵权即删。
