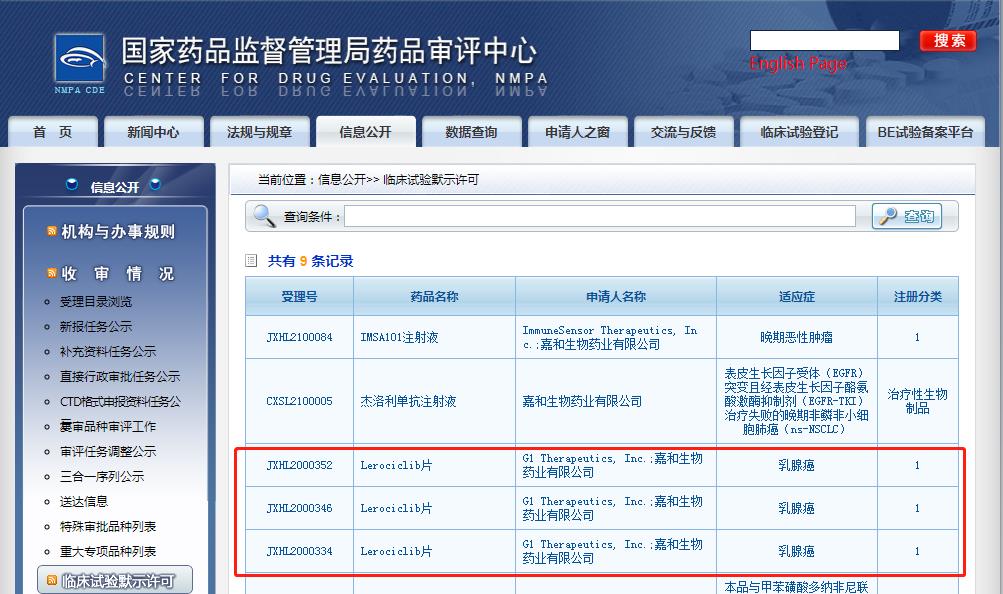
2021年7月20日,嘉和生物药业有限公司宣布,其CD K4/6抑制剂GB491(lerociclib)的两项用于乳腺癌治疗的3期临床试验已获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)批准。
图片来源:CDE官网
关于乳腺癌
据今年世界卫生组织国际癌症研究机构(IARC)发布的全球最新癌症数据显示,2020 年中国乳腺癌新发病例数42 万,乳腺癌死亡人数达 12 万例。晚期乳腺癌患者的5年生存率较低,其中占比较大的是HR+/HER2-型患者。
与其他国家不一样的是,HR+/HER2-是常见的类型,在中国乳腺癌患者中的占比约为62%[1]。
据介绍,GB491(Lerociclib)此次获得批准开展的是两项多中心、随机双盲、安慰剂对照3期临床试验,一项是二线联合氟维司群治疗既往接受内分泌治疗后疾病进展的HR+/HER2-的局部晚期或转移性乳腺癌;另一项是一线联合来曲唑治疗既往未经过系统性抗肿瘤治疗的激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的局部晚期或转移性乳腺癌。
关于周期蛋白依赖性激酶(CDK)
周期蛋白依赖性激酶(CDK)属于丝氨酸/苏氨酸蛋白激酶家族成员之一,在细胞周期调节中起着至关重要的作用。其中,CDK 4/6目前被认为是驱动细胞分裂的关键调节因子。CDK 4/6在许多癌细胞中呈现过表达的现象,导致癌细胞分裂周期失控,无限增殖。
GB491是由美国G1 Therapeutics公司开发的一款口服CDK 4/6抑制剂,嘉和生物于2020年6月向美国G1 Therapeutics公司取得亚太地区(不包括日本)的专有权许可。
期待GB491(Lerociclib)的后续临床研究顺利进行,早日获批上市,为患者带来新的治疗希望。
参考文献:
[1]. Su Y, Zheng Y, Zheng W, et al. Distinct distribution andprognostic significance of molecular subtypes of breast cancer in Chinesewomen: a population-based cohort study[J]. BMC Cancer, 2011, 11(1): 1-11.
