2021年5月24日,武田(Takeda)口服小分子新药mobocertinib胶囊上市申请被国家药品监督管理局(NMPA)药品审评中心(CDE)以“符合附条件批准的药品”批准拟纳入优先审评并开始公示。值得关注的是,2020年10月,也获得了CDE突破性疗法认定。

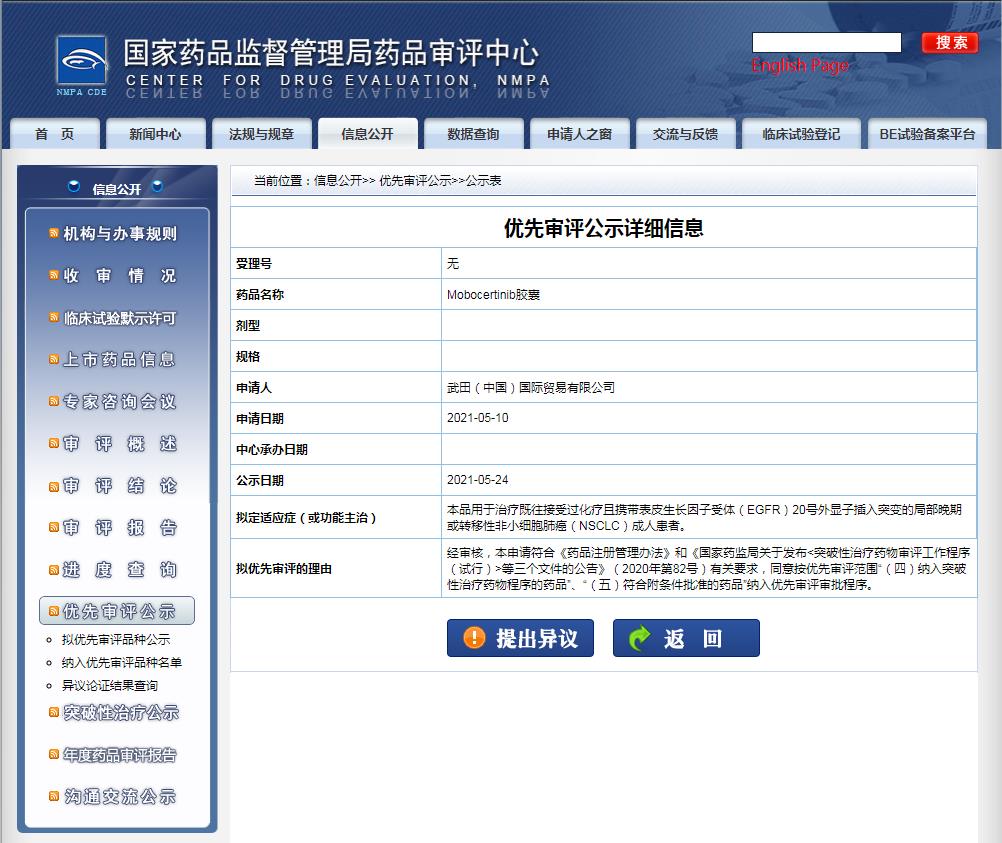


图片来源:CDE官网
拟定适应症(或功能主治)为:治疗既往接受过化疗且携带表皮长因子受体(EGFR)20号外显子(Exon20)插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
Mobocertinib胶囊是一种下一代小分子酪氨酸激酶抑制剂(TKI),在2020年4月美国食品药品监督管理局(FDA)正式授予突破性疗法认定,用于治疗在含铂化疗期间或之后疾病进展的EGFR Exon20插入突变NSCLC患者。mobocertinib针对这项适应证的上市申请,在4月27日,美国食品药品管理局(FDA)给予优先审评资格。
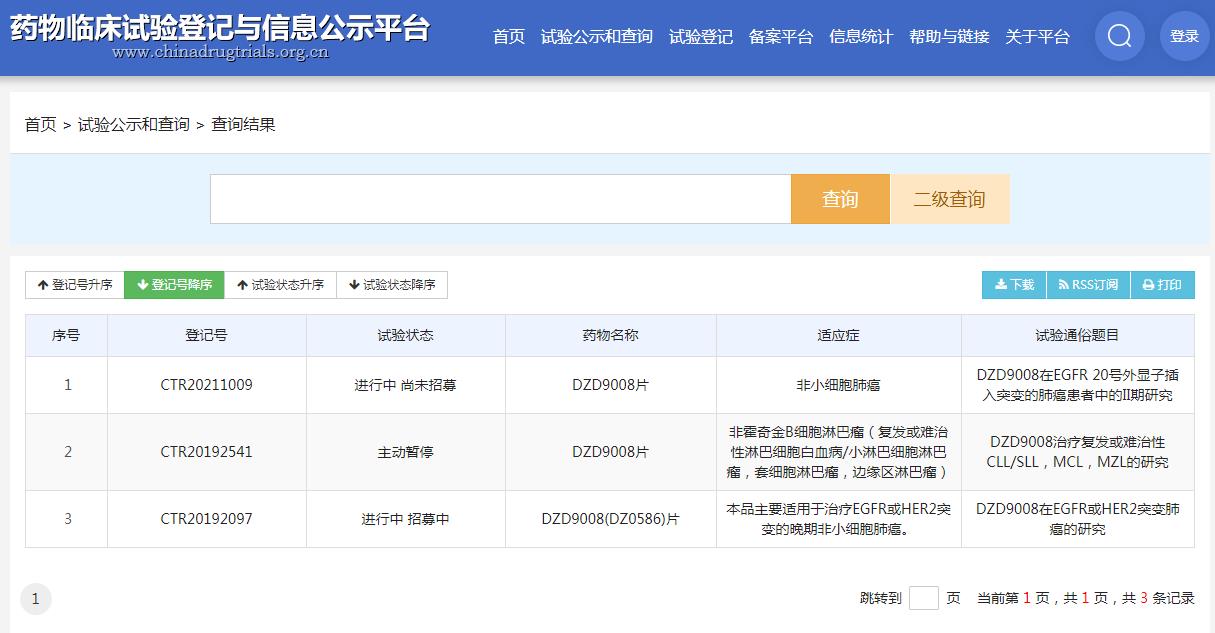

图片来源:药物临床试验登记与信息公示平台
国内在研的靶向EGFR Exon20的药物中,除了武田的mobocertinib胶囊已申报上市外,再鼎医药的EGFR抑制剂CLN-081、君境生物的EGFR exon20小分子抑制剂AP-L1898均已批准临床。此外,迪哲医药DZD9008正处于II期临床阶段。
关于非小细胞肺癌
肺癌是与癌症相关的死亡的常见原因,非小细胞肺癌是肺癌占比较高的亚型。当前,针对非小细胞肺癌的药物也有很多,但是有一类患者例外,那就是EGFR外显子20插入阳性的转移性非小细胞肺癌患者。
这类患者在亚洲人群中较为常见,在非小细胞肺癌患者中大概占1-2%。针对这类患者,目前国内外针对这类患者的获批药物还十分空白,而当前可用的表皮生长因子受体络氨酸激酶抑制剂(EGFR-TKI)和化疗为这些患者提供的获益比较局限。所以,这一类患者的生存率和预后较差,迫切需要找到其他的的靶向治疗来帮助应对这.一难题。
祝贺武田mobocertinib获得CDE优先审评,希望该产品在临床研究中进展顺利,早日为更多非小细胞肺癌患者带来新的治疗选择。
