2021年5月12日,由江苏万邦生化医药递交的甲磺酸奥希替尼片仿制药上市申请已获得国家药品监督管理局药品审评中心(CDE)受理,是国内的一个申报上市的奥希替尼仿制药。
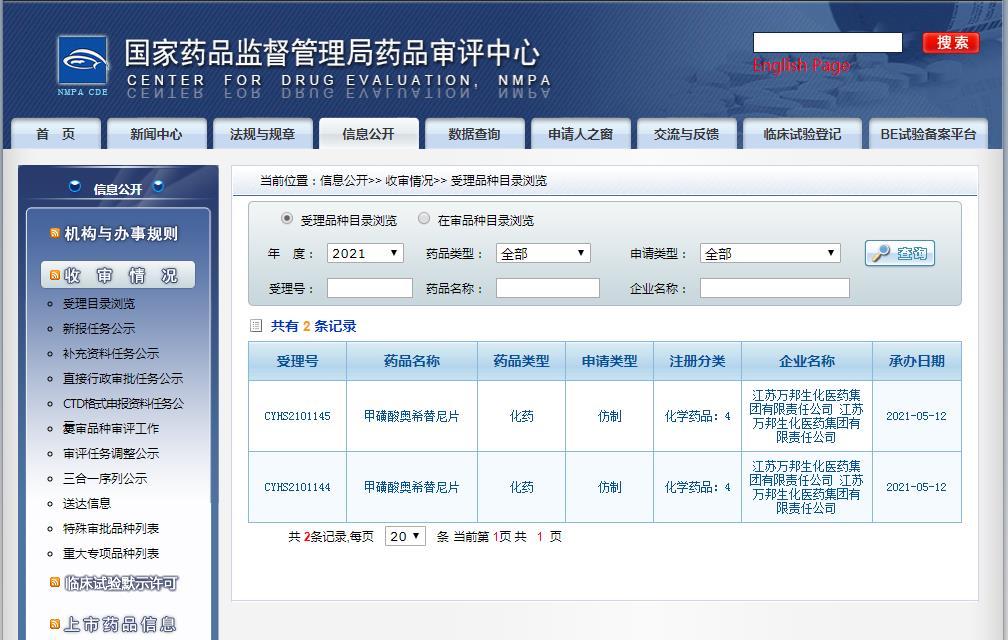
图片来源:CDE
万邦医是国内目前一家登记BE研究的企业,2020年8月完成了奥希替尼BE临床研究后向国家药监局递交了上市申请。
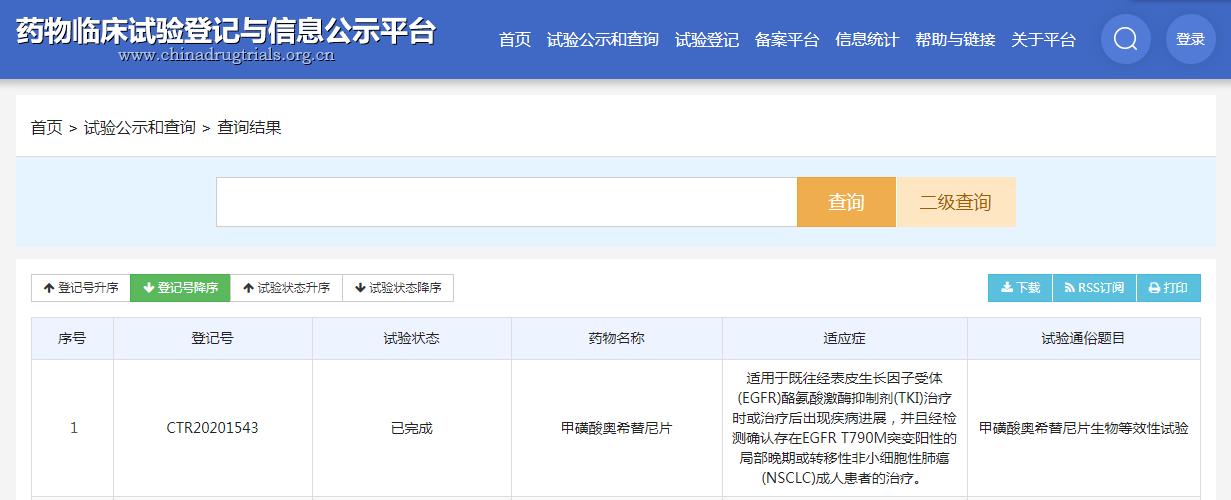
图片来源:药物临床试验登记与信息公示平台
值得一提的是,奥希替尼原研药是由阿斯利康制药公司研发生产的。阿斯利康的甲磺酸奥希替尼片于2017年3月在中国首次获批,获批适应症为适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。

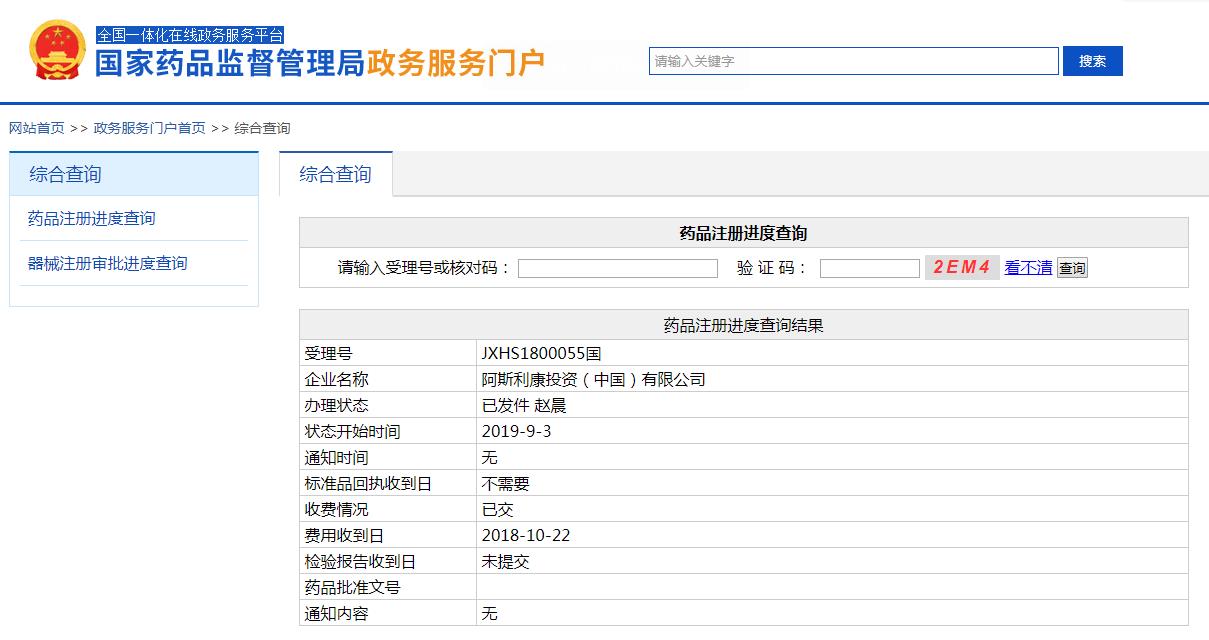
图片来源:CDE
2019年9月3日,甲磺酸奥希替尼片获得国家药品监督管理局(简称"NMPA")正式批准,获批适应症为用于具有表皮生长因子受体(EGFR)外显子19缺失或?显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
2020年12月,奥希替尼通过续签以一线和二线适应症全部纳入新版医保乙类药品目录。
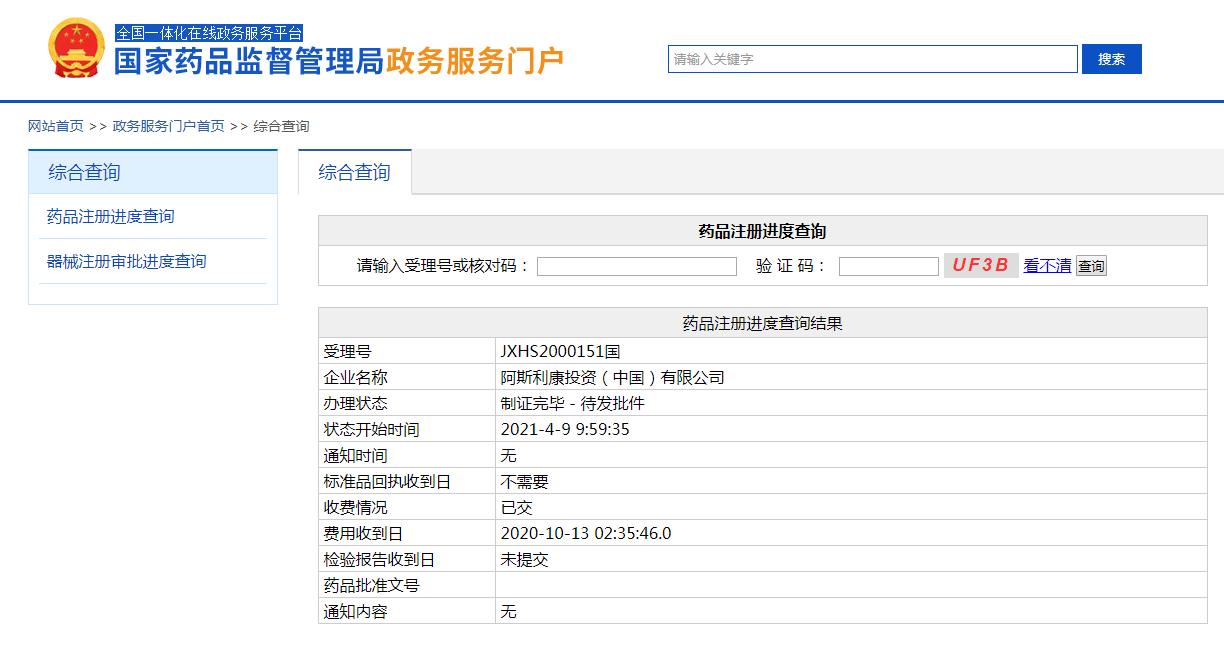
图片来源:CDE
2021年4月8日,国家药品监督管理局(NMPA)批准奥希替尼新的适应症,用于具有表皮生长因子受体(EGFR)敏感突变的非小细胞肺癌(NSCLC)成人患者肿瘤切除术后的辅助治疗,这是获批的第3个适应症。



