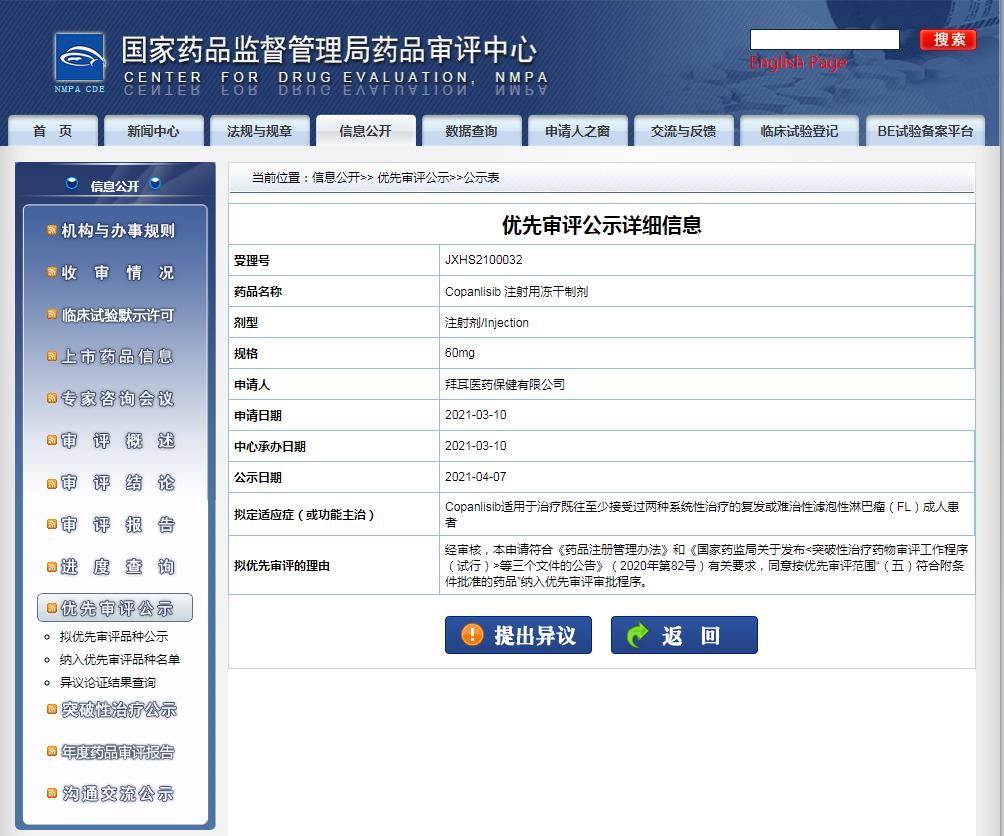
2021年4月8日,中国国家药品监督管理局药品审批中心(CDE)官网显示,拜耳在中国提交的Copanlisib注射用冻干制剂上市申请拟纳入优先审评,该产品上市申请于3月10日获CDE受理,用于治疗既往至少接受过两种系统性治疗的发或难治性滤泡性淋巴瘤(FL)成人患者。
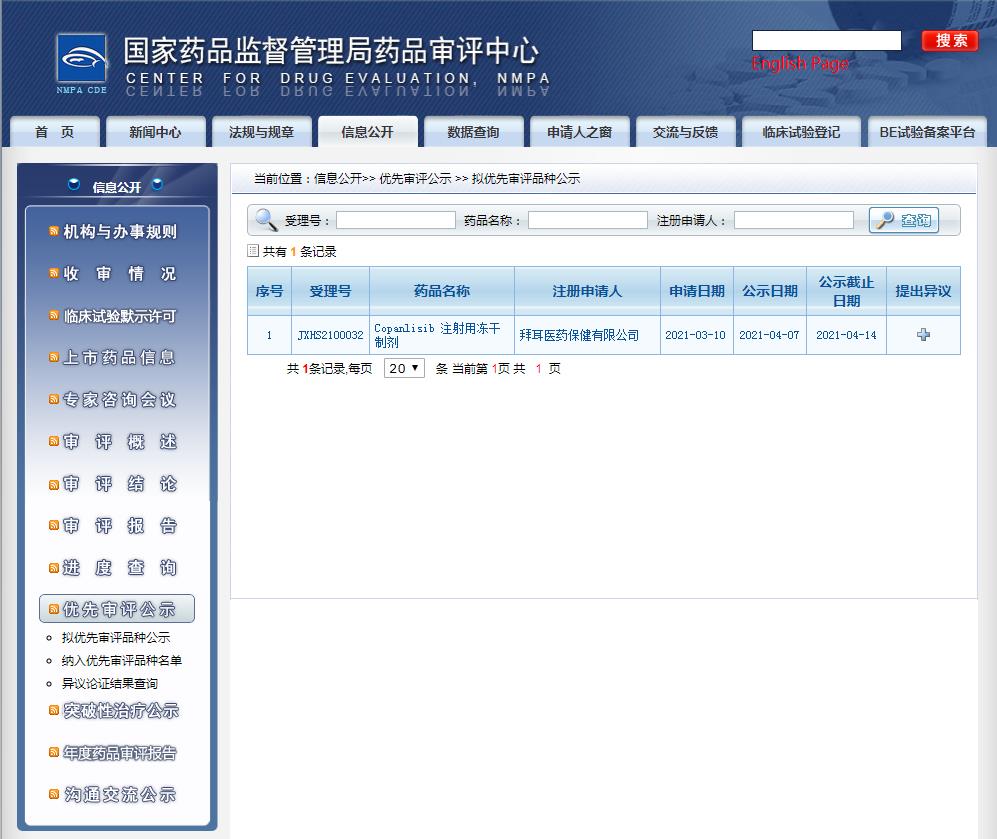


图片来源:CDE官网
Copanlisib是一种通过脉注射的磷脂酰肌醇-3-激酶(PI3K)抑制剂,已于2017年9月获FDA批准上市,用于治疗已接受过至少2线治疗后复发的滤泡性淋巴瘤(FL)患者。
此外,Copanlisib于2020年12月在获中国国家药品监督管理局药品审批中心(CDE)突破性疗法认定,拟定适应症为用于:治疗既往接受过至少两线治疗的复发性边缘区淋巴瘤(MZL)成人患者。


图片来源:CDE官网
除了拜耳的Copanlisib已申报上市外,现处于III期临床阶段的分别有诺华的阿吡利塞、Buparlisib ,罗氏的Taselisib、GDC-0077 。处于I/II期临床阶段的本土企业有正大天晴、信达、和记黄埔、石药。
关于滤泡性淋巴瘤(FL)
滤泡性淋巴瘤(FL)是一种常见的非霍奇金淋巴瘤(NHL),是常见的血液系统肿瘤之一。近年来,其发病率有逐渐增加的趋势。该病的症状因人而异,主要的表现为淋巴结肿大,一般没有明显的疼痛感,皮肤瘙痒,持续低热,红斑,皮疹等症状。很多患者就医的时候常常会出现弥漫性浸润。严重的时候全身各个器官可以出现症状。
滤泡性淋巴瘤容易引发非常多的并发症,R-CHOP及类似方案经常被应用,少部分的患者会出现早期进展,对于经过治疗的大多数初治患者,在经过疾病稳定期后往往也会进入复发、难治阶段。所以,复发或难治性滤泡淋巴瘤患者依然存在未满足的需求。
