2021年3月18日,基石药业靶向药阿泊替尼片(avapritinib)上市申请(受理号:JXHS2000050、JXHS2000051 、JXHS2000052)办理状态在国家药品监督管理局(NMPA)药品注册进度查询结果显示为“在审批”,有望于近日获批上市。即将获批的2个适应症分别为:①四线不可手术切除或转移性GIST成人患者;②用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者。

图片来源:NMPA官网
胃肠道间质瘤(GIST)是一种间叶组织肿瘤,临床上一般比较少见。它可以发生在消化道的任何一个部位,较为常见的部位通常通是胃和小肠。据了解,中国每年大概有1-1.5/10万(1.4万-2.1万)新诊断的胃肠道间质瘤患者[1],大概90%胃肠道间质瘤患者的致病因素与KIT或PDGFRA基因突变有关。
Avapritinib由基石药业合作伙伴Blueprint Medicines开发,是一款KIT和PDGFRA突变激酶抑制剂。基石药业2018年6月通过与BlueprintMedicines达成合作,引进了包括avapritinib在内的3种药物的大中华区开发和商业化权益,BlueprintMedicines保留在其他地区的开发及商业化avapritinib的权利。
Avapritinib在2020年1月获得美国FDA批准,用于治疗携带PDGFRA外显子18突变的不可手术切除或转移性GIST成人患者,同时这也是一款在美国上市的针对PDGFRA外显子18突变治疗的靶向药。
Avapritinib获得美国FDA批准上市后,三个月的时间,基石药业于2020年4月29日递交了阿泊替尼上市申请获国家药品监督管理局(NMPA)药品审评中心(CDE)承办,同年7月25日以“符合附条件批准的药品”为由该申请正式纳入优先审评审批。


图片来源:CDE官网
除此之外,基石药业从Blueprint Medicines引进的另一款抗癌药普拉替尼(pralsetinib)新药上市申请也在国家药监局(NMPA)药品注册进度查询结果显示为“在审批”,有望近期获批上市。
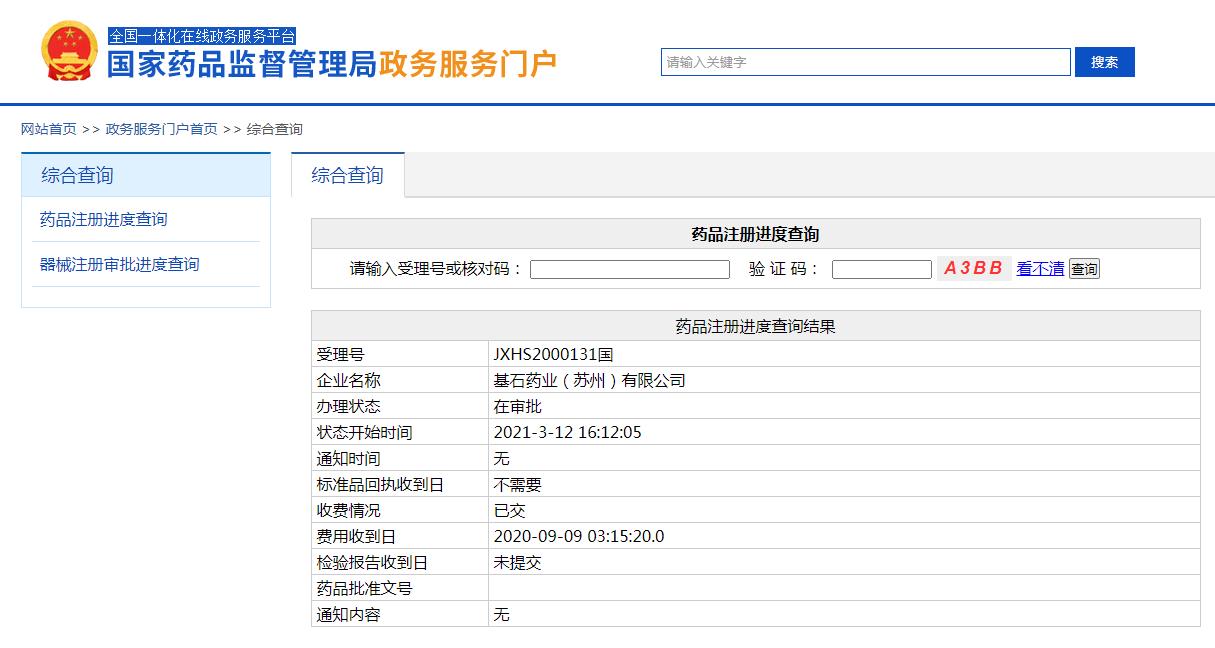
图片来源:CDE官网
期待基石药业的阿泊替尼获批之后,可以为携带此种突变的胃肠道间质瘤患者带来希望。
参考文献:
[1] 周岩冰. 胃肠道间质瘤的诊断与治疗现状[J]. 中华普通外科杂志, 2017, 032(007):549-552.
