11 月 30 日,国家药监局药品审评中心(CDE)官网最新公示,上海科济制药的 CT053 全人抗 BCMA 自体 CAR-T 细胞注射液拟纳入突破性疗法,用于治疗复发难治多发性骨髓瘤。
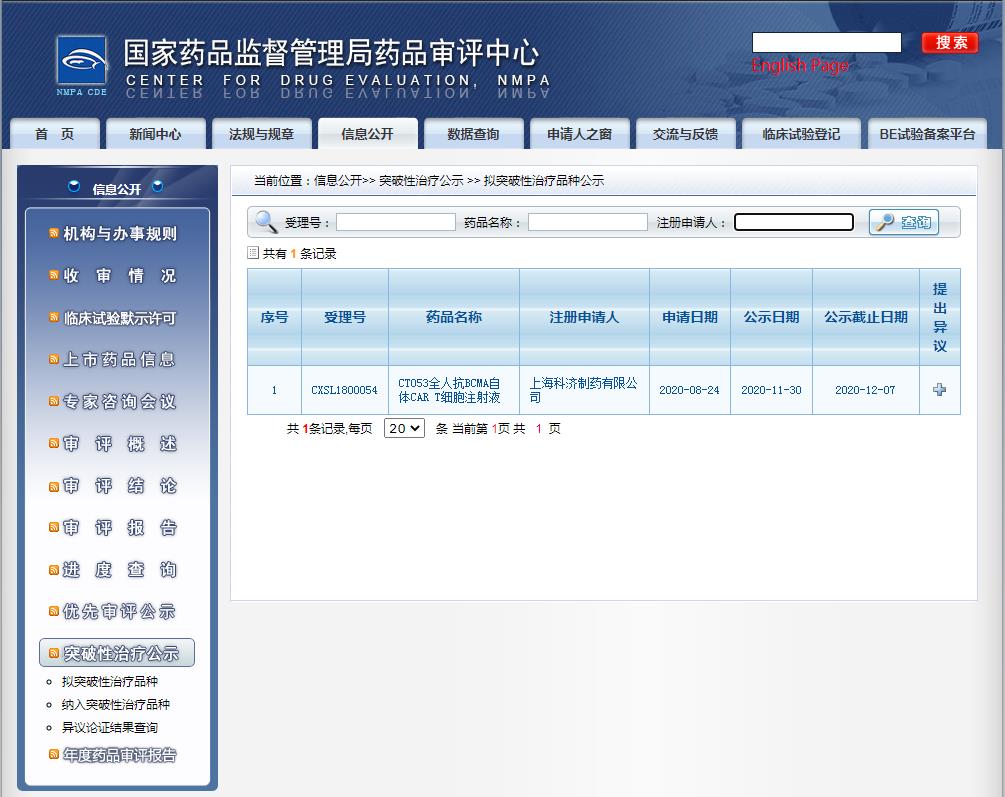
截图来源:CDE官网
这是第 3 个拟纳入突破性疗法的 CAR-T 产品,与此前纳入突破性疗法的传奇生物 LCAR-B38M 同样靶向 BCMA。
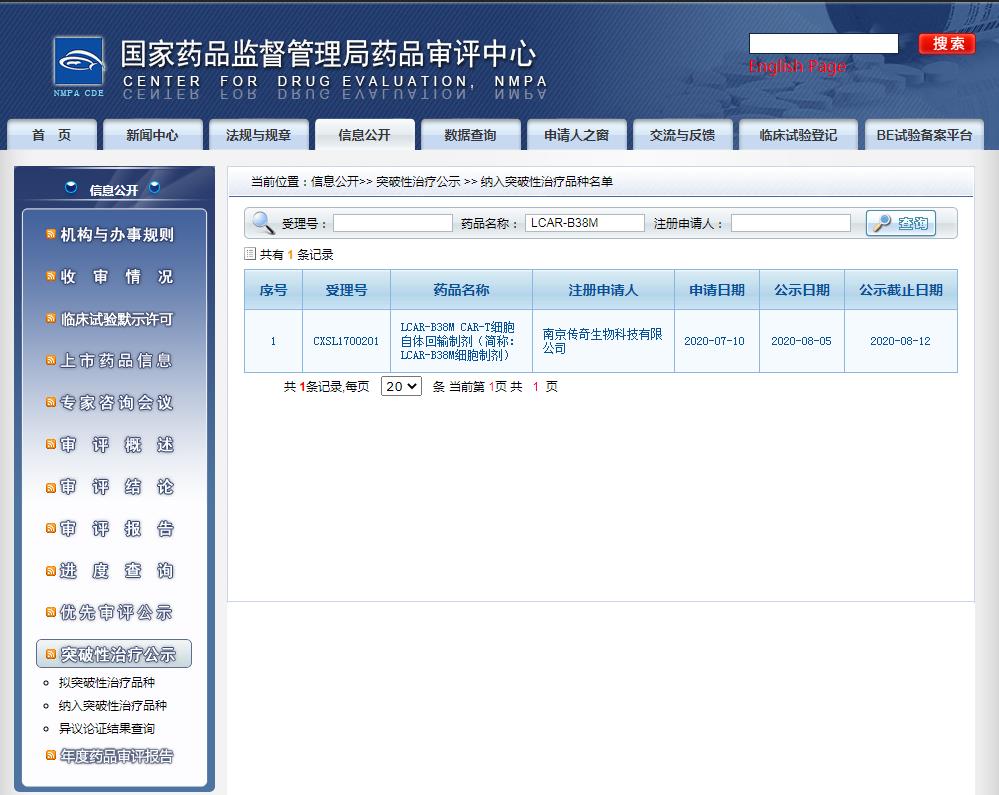
截图来源:CDE官网
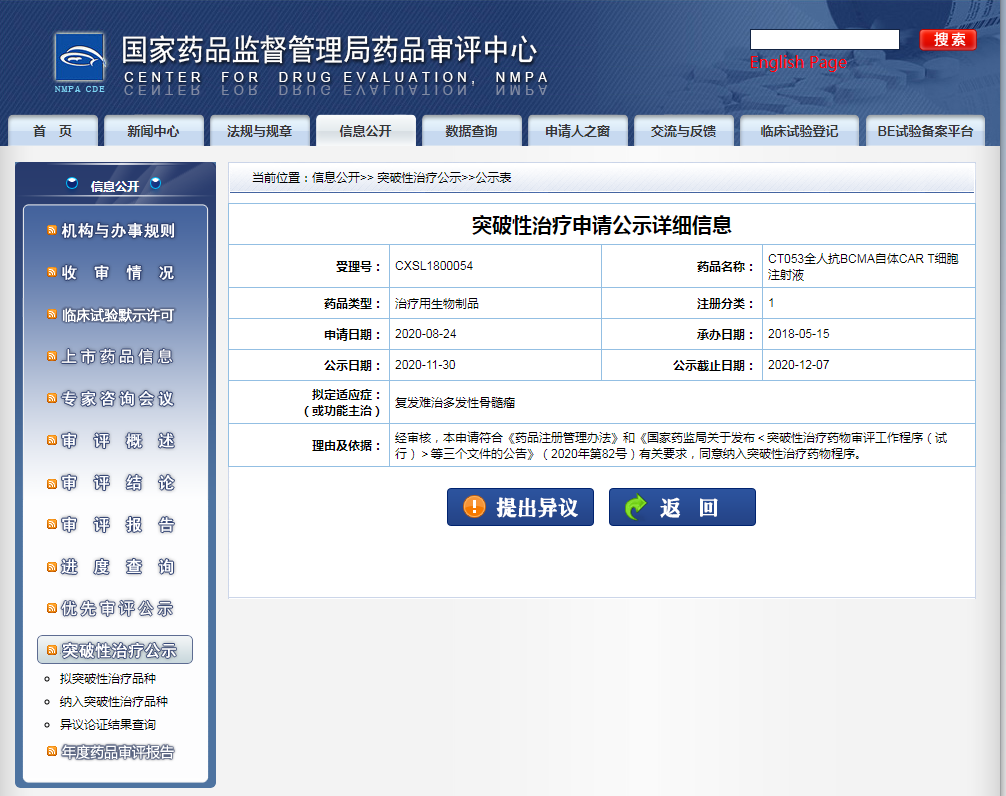
CT053 是科济生物开发的全人抗 BCMA 的 CAR-T 细胞产品,用于复发难治多发性骨髓瘤。目前,该药在国内正处于 I/II 期临床阶段(CTR20190955)。
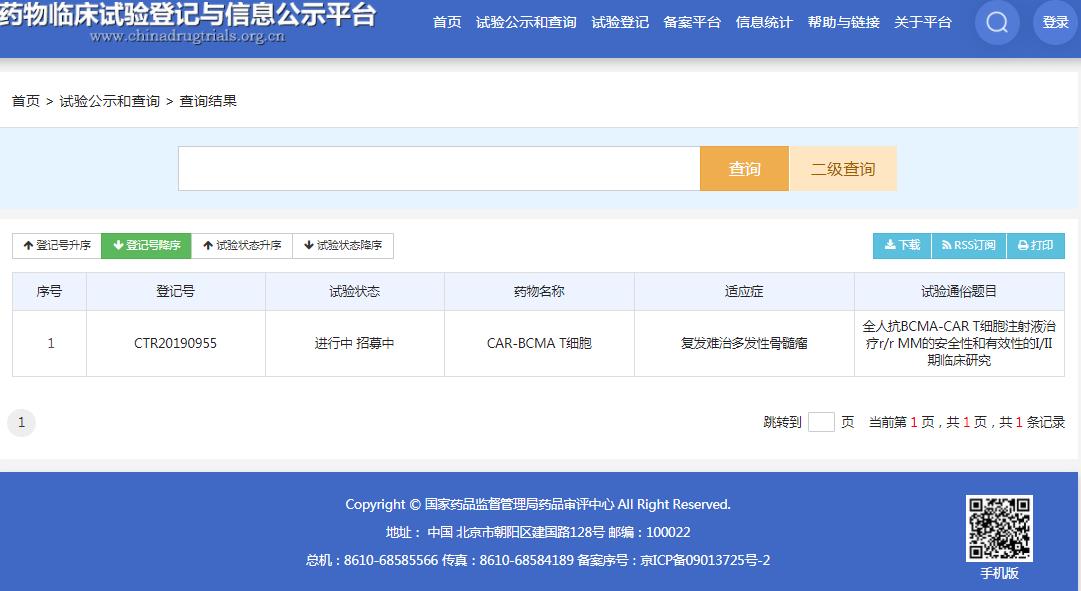
截图来源:CDE官网
多发性骨髓瘤是一种克隆性浆细胞异常增殖的恶性疾病,复发/难治多发性骨髓瘤(R/R MM)有重大的未满足的医学需求。B 细胞成熟抗原(BCMA)靶向的嵌合抗原受体CAR)基因工程修饰的 T 细胞,被认为是一种治疗多发性骨髓瘤的新手段。本次科济的 CT053 拟纳入突破性疗法,将获得CDE 更多的临床指导和沟通交流机会,加速其临床开发。
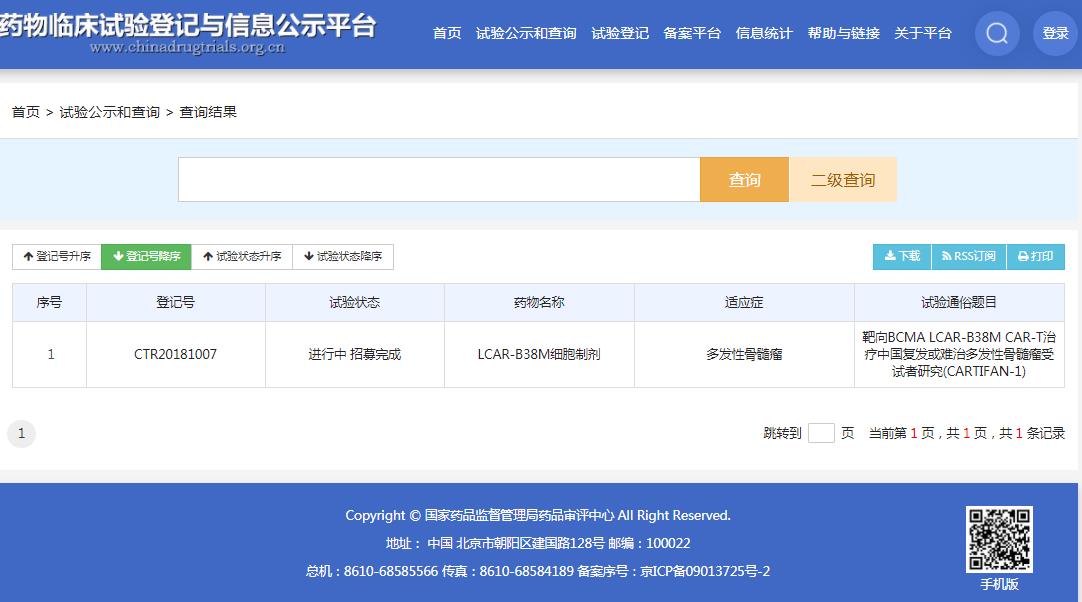
截图来源:CDE官网
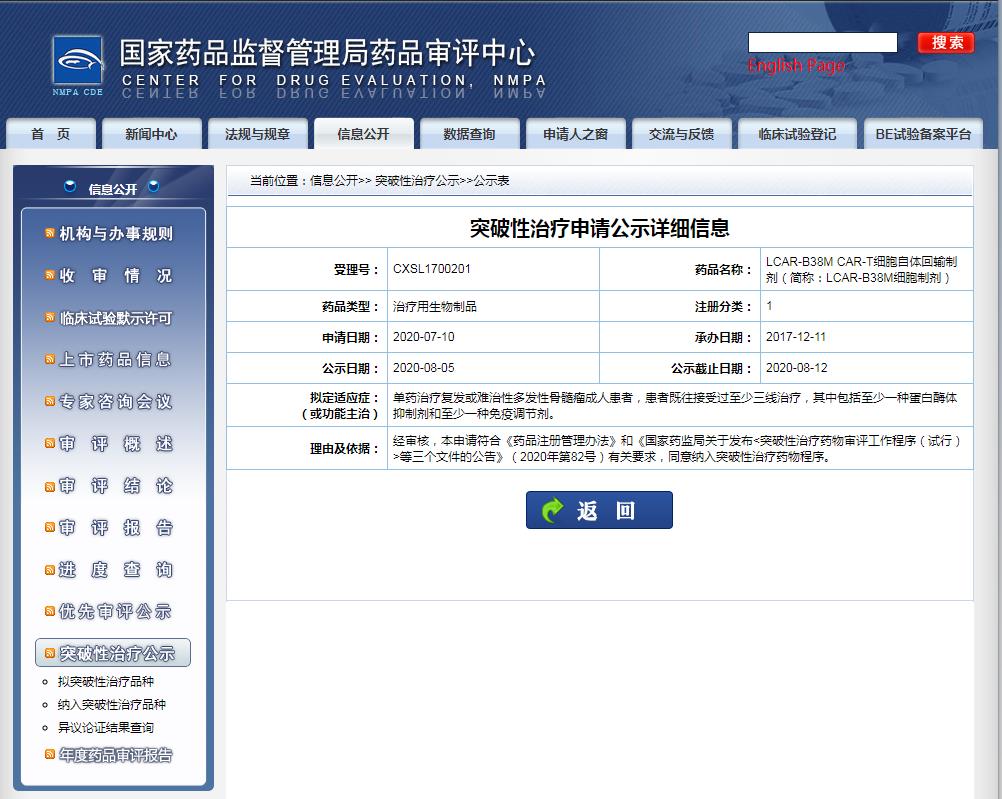
此前被纳入突破性疗法的传奇生物/强生合作开发的 LCAR-B38M / JNJ4528 同样是靶向 BCMA。该药进展快于 CT053,目前已启动 全球随机 3 期临床试验( CARTITUDE-4)。此外,同靶点 CAR-T 产品中,BMS/蓝生物的 idecabtagene vicleucel (ide-cel,bb2121) 也是竞争者。
