2021年7月19日,协和麒麟(中国)制药有限公司递交的「莫格利珠单抗注射液」上市申请因“符合条件批准的药品”被中国国家药品监督管理局药品审评中心(CDE)纳入拟优先审评,拟开发用于治疗两类常见的皮肤T细胞淋巴瘤。
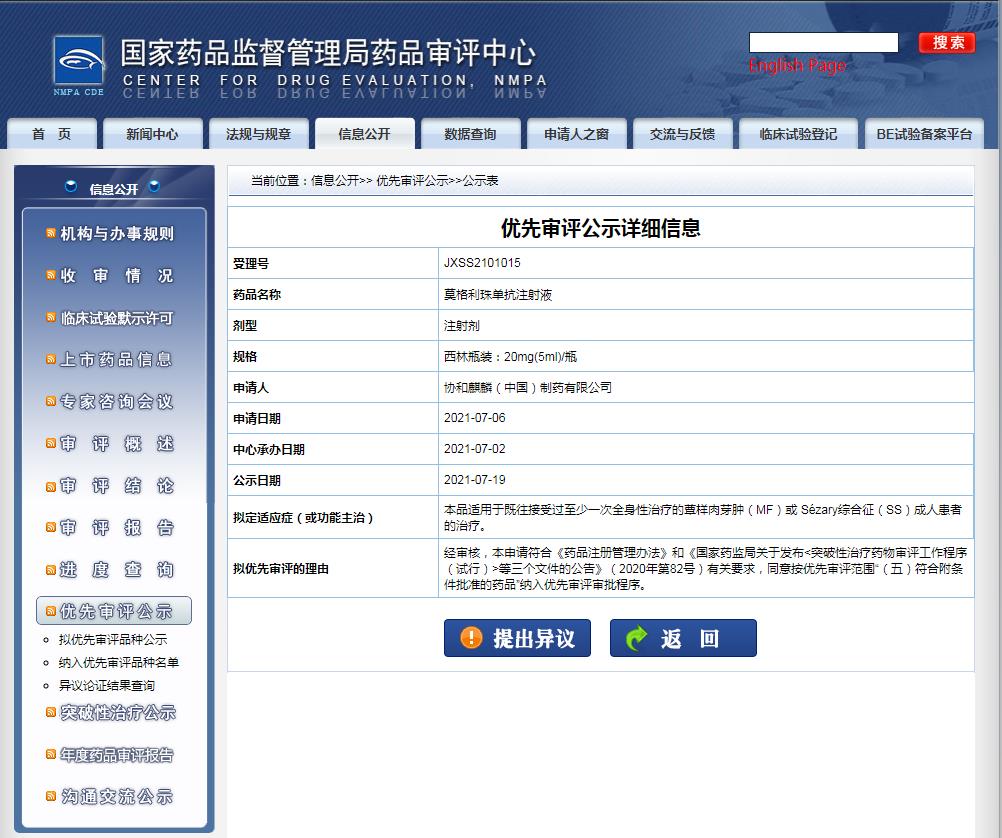
截图来源:CDE官网
2021年7月2日,莫格利珠单抗在中国的上市申请获得受理,拟定适应症(或功能主治)为:适用于既往接受过至少一次全身性治疗的蕈样肉芽肿(MF)或 Sézary综合征(SS)成人患者的治疗,这是两类常见的皮肤T细胞淋巴瘤。
莫格利珠单抗是一款人源化CC趋化因子受体4(CC chemikon receptor 4,CCR4)单克隆抗体,曾在2018年8月获得美国FDA批准上市,治疗已经接受过至少一次全身性疗法的复发或难治性蕈样真菌病或塞扎里综合症成年患者。CCR4蛋白是在恶性血液疾病患者体内的淋巴细胞表面频繁表达的一种蛋白,也表达于皮肤T细胞淋巴瘤患者体内。
关于皮肤T细胞淋巴瘤
皮肤T细胞淋巴瘤属于一种不十分常见的非霍奇金淋巴瘤,皮肤T细胞淋巴瘤常见的两种类型主要包括蕈样真菌病(mycosisfungoides,MF)和塞扎里综合症(Sezary syndrome, SS),其中,塞扎里综合症是影响血液和淋巴结的一种少见皮肤淋巴瘤。而蕈样真菌病比较常见,它可以引起瘙痒的红疹和皮肤伤口,并且可以扩散到身体的其他部位,这种类型大概占所有皮肤淋巴瘤的50%-70%。
此外,皮肤T细胞淋巴瘤可能可以侵犯淋巴结、皮肤、血液和内脏器官,是可能导致毁容和令人衰弱的一种疾病。晚期阶段的皮肤T细胞淋巴瘤与严重的发病率和死亡率相关,且治疗难度较大存在很大的未被满足的医疗需求,因此患者急需新的治疗方案。
祝贺莫格利珠单抗被纳入拟优先审评,希望其能够早日在中国获批上市,为更多皮肤T细胞淋巴瘤患者提供了更多治疗选择,并使这些患者获益。
