2021年8月16日,中国国家药品监督管理局(NMPA)公示,百济神州(北京)生物科技有限公司(以下简称:百济神州)申报的引进的达妥昔单抗β(又称:迪妥昔单抗)上市申请已正式获得批准,目前药品批准证明文件为“待领取”状态。
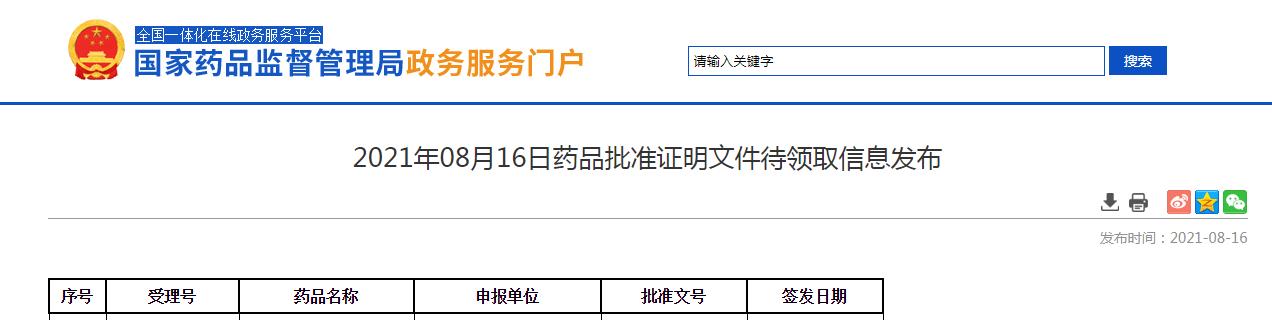

截图来源:药监局官网
此次达妥昔单抗β获批的两项适应症为:1) 治疗伴或不伴有残留病灶的复发性或难治性神经母细胞瘤;2) 治疗≥12月龄的高危神经母细胞瘤患者,这些患者既往接受过诱导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗。
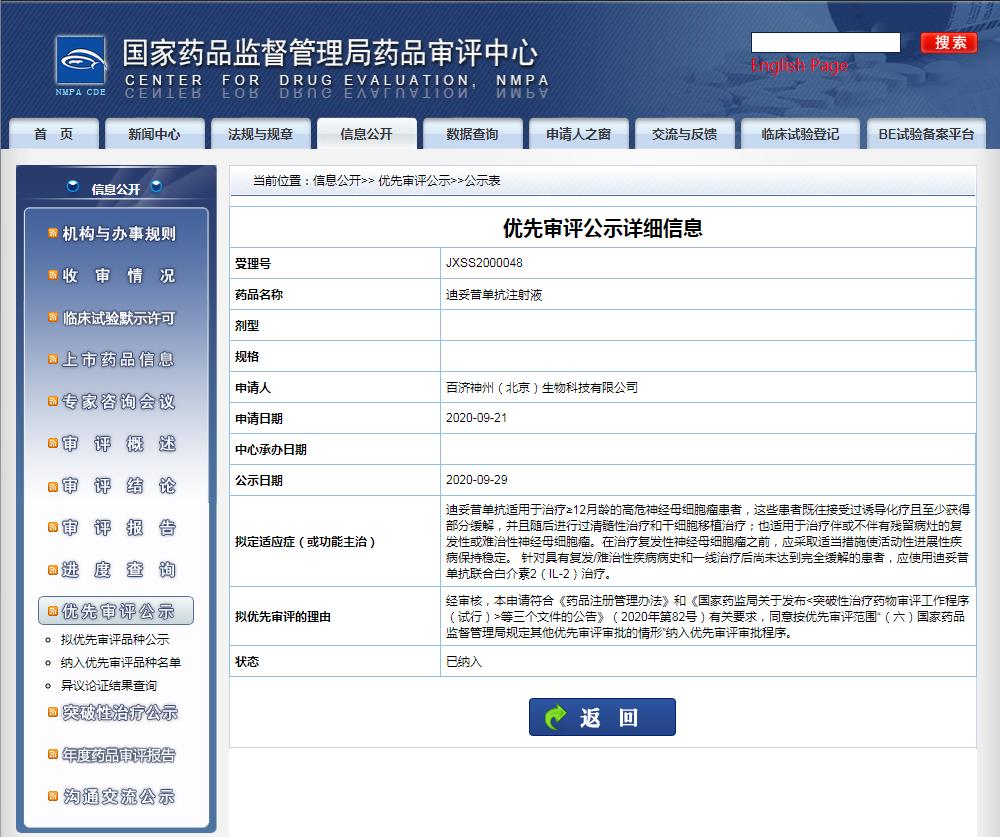
截图来源:CDE官网
根据早前的消息显示,达妥昔单抗β是去年百济神州从EUSA Pharma(简称EUSA)引进的一款GD2靶向单克隆抗体Qarziba(dinutuximab beta),值得一提的是,这个产品还被中国国家药品监督管理局(NMPA)药品审评中心(CDE)纳入优先审评。
关于神经母细胞瘤
神经母细胞瘤是一种交感神经系统的恶性肿瘤,在婴幼儿中比较常见,占儿童恶性肿瘤的 8%~10%。因为恶性程度高,治疗难度大,它被称为“儿童肿瘤之王”。
由于神经母细胞瘤的原发部位隐秘、容易发生转移,不仅早期诊断困难,而且大概有一半的的患者在确诊的时候通常已经处于高危状态,并已发生远处转移。神经母细胞瘤是一种侵袭性的肿瘤,有高危神经母细胞瘤的儿童往往需要通很多轮复杂而密集的治疗,而且即使高危神经母细胞瘤患者通过了综合治疗,预后依然较差,长期生存率不到50%。因此,高危患者急需更新的治疗手段,以增加长期生存的机会。
目前,除了手术、放疗之外,用于治疗神经母细胞瘤的药物包括化疗药物和免疫治疗药物两种,治疗方案不足。特别是在国内,针对高危神经母细胞瘤的免疫治疗药物如今还尚未获批,患者对该类疗法的需求还远远未能满足。
祝贺百济神州引进的达妥昔单抗β在中国正式获批,将会为更多中国儿童高危神母细胞瘤患者带来新的治疗选择。
